Змінити пароль!
Скинути пароль!


На сьогодні вже мільйони людей по всьому світу перехворіли на COVID-19.
Ефективність вакцини ZyCoV-D проти COVID-19 при внутрішньошкірному введенні становить 66,6%.
На сьогодні вже мільйони людей по всьому світу перехворіли на COVID-19. Пацієнти з коронавірусною інфекцією (переважно у віці до 60 років), а також пацієнти з уже наявними захворюваннями органів дихання або серцево-судинними захворюваннями піддаються більш високому ризику розвитку серйозних ускладнень та смерті. Поширення COVID-19 призвело до підвищення рівня смертності та спаду національної економіки. Доки більша частина світового населення не буде вакцинована, залишається ризик підвищення рівня захворюваності COVID-19 та негативного впливу цього вірусу на соціальне та економічне життя.
Вже зареєстровано низку вакцин проти коронавірусу, але їх все ще недостатньо для боротьби з пандемією. Саме тому необхідно забезпечити виробництво вакцин у великих масштабах, їхнє широке застосування на місцевому рівні, поширення по всьому світу та прийнятну вартість. Ефективного розподілу вакцин країнами можна досягти, розробивши стійкі до впливу температур препарати: в такому разі дотримання холодового ланцюга не потрібно. Поява ДНК-вакцини ZyCoV-D дозволяє подолати труднощі виробництва та транспортування РНК-вакцин.
Ключовою характеристикою вакцини ZyCoV-D є стабільність при кімнатній температурі. Вакцину зберігали при температурі 2-8 °C, але при зберіганні при кімнатній температурі (25 °C) вона зберігала стабільність протягом не менше 3 місяців. Це відповідає всім критеріям прийнятності, встановленим Управлінням контролю якості харчових продуктів та лікарських засобів США, а також у міжнародних керівництвах. Результати дослідження стабільності вакцини у відкритих флаконах свідчать про стерильність та стабільність вакцини ZyCoV-D протягом 28 днів. Це дозволяє скоротити втрати вакцини, тому що не потрібно чекати, поки набереться група з кількох людей на введення вакцини з одного флакона.
Згідно з результатами адаптивного дослідження I/II фази з оцінки застосування вакцини ZyCoV-D у здорових добровольців, 43 пацієнти з 48 завершили дослідження I фази тривалістю 84 дні, а 911 пацієнтів з 1000 – дослідження II фази тривалістю 224 дні. Про розвиток проблем безпеки при введенні вакцини ZyCov-D у дозі до 2 мг шляхом голкової або безголкової ін'єкції не повідомлялося. Вакцинація сприяла розвитку достатньої імунної та вираженої клітинної відповіді. Крім того, вакцина мала сприятливий профіль переносимості та безпеки.
ОБГРУНТУВАННЯ ДОСЛІДЖЕННЯ
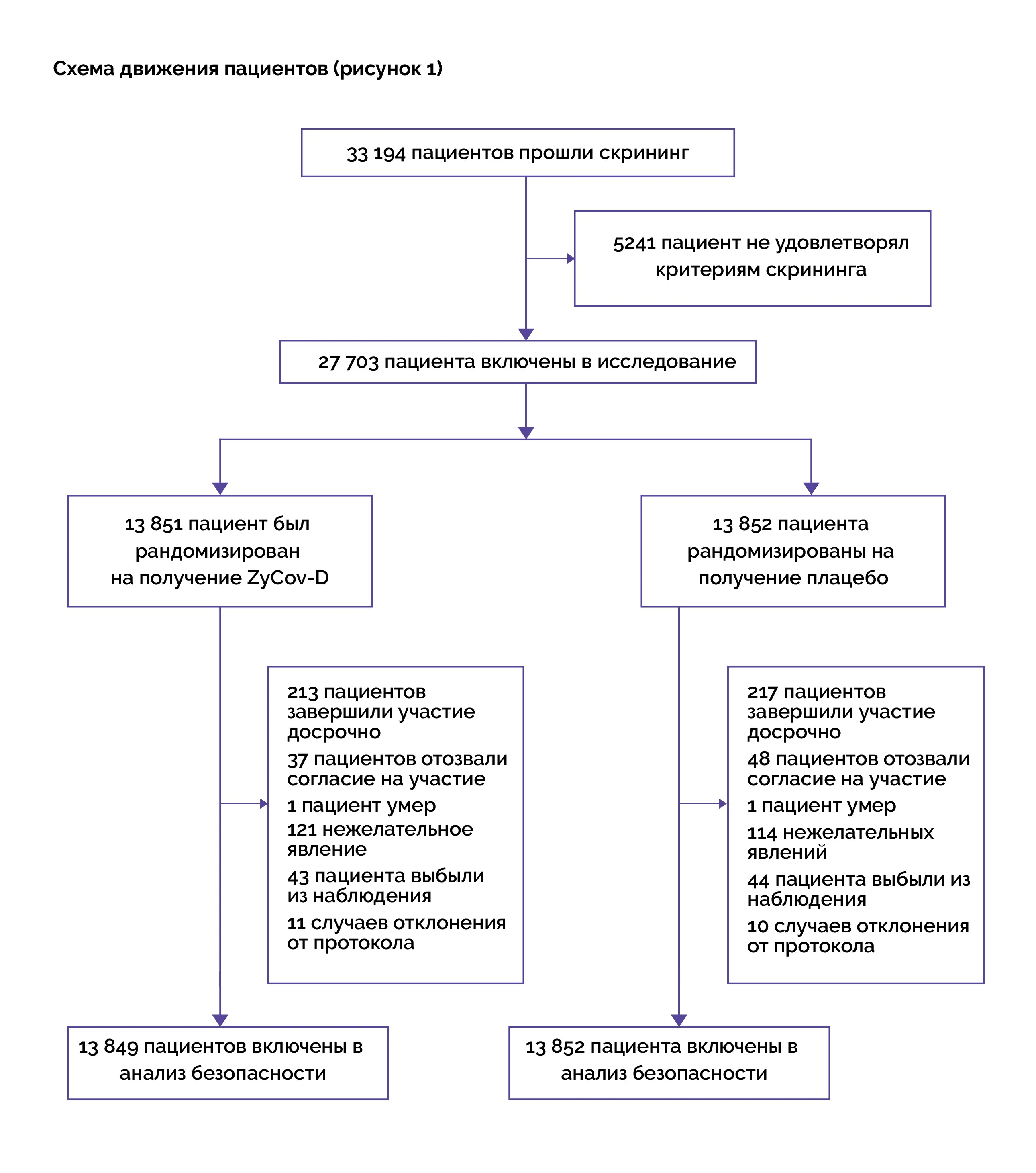
У жодному з раніше проведених досліджень не оцінювали ефективність вакцини на основі плазмідної ДНК проти COVID-19. Тому було проведено це рандомізоване подвійне сліпе плацебо-контрольоване багатоцентрове дослідження ІІІ фази.
МЕТА
Проведено проміжний аналіз для комплексної оцінки ефективності, безпеки та імуногенності вакцини ZyCov-D проти COVID-19.

Кінцеві точки дослідження
Основною заздалегідь визначеною кінцевою точкою була загальна кількість пацієнтів із вперше виявленою COVID-19 з клінічними проявами через 28 днів після введення третьої дози вакцини ZyCoV-D до досягнення цільового числа випадків (n = 158).
Додатковими заздалегідь визначеними кінцевими точками були кількість пацієнтів з вперше виявленою COVID-19 без клінічних проявів, COVID-19 важкого ступеня, COVID-19 середнього ступеня та COVID-19 легкого ступеня, а також число смертельних наслідків від COVID-19, підтверджених результатами вірусологічного аналізу через 28 днів після введення третьої дози вакцини до досягнення цільового числа випадків.
Оцінка імуногенності включала рівень сероконверсії на підставі визначення антитіл IgG до домену S1 білка методом ІФА, середній геометричний титр (СГТ), фактор сероконверсії та титри нейтралізуючих антитіл.
РЕЗУЛЬТАТИ
Вихідний рівень: на початковому рівні статистично значущих відмінностей між групами не виявлено.
Кінцеві точки дослідження
• Ефективність вакцини ZyCoV-D становить 66,6 %.
• Відзначається порівнянна частота розвитку побічних ефектів в обох групах (4,49% у групі застосування ZyCoV-D та 4,47% у групі плацебо).
• На момент закінчення збору даних було зареєстровано 2 смертельні випадки (по 1 випадку у кожній групі). Жоден із смертельних випадків не був пов'язаний із досліджуваним лікуванням.
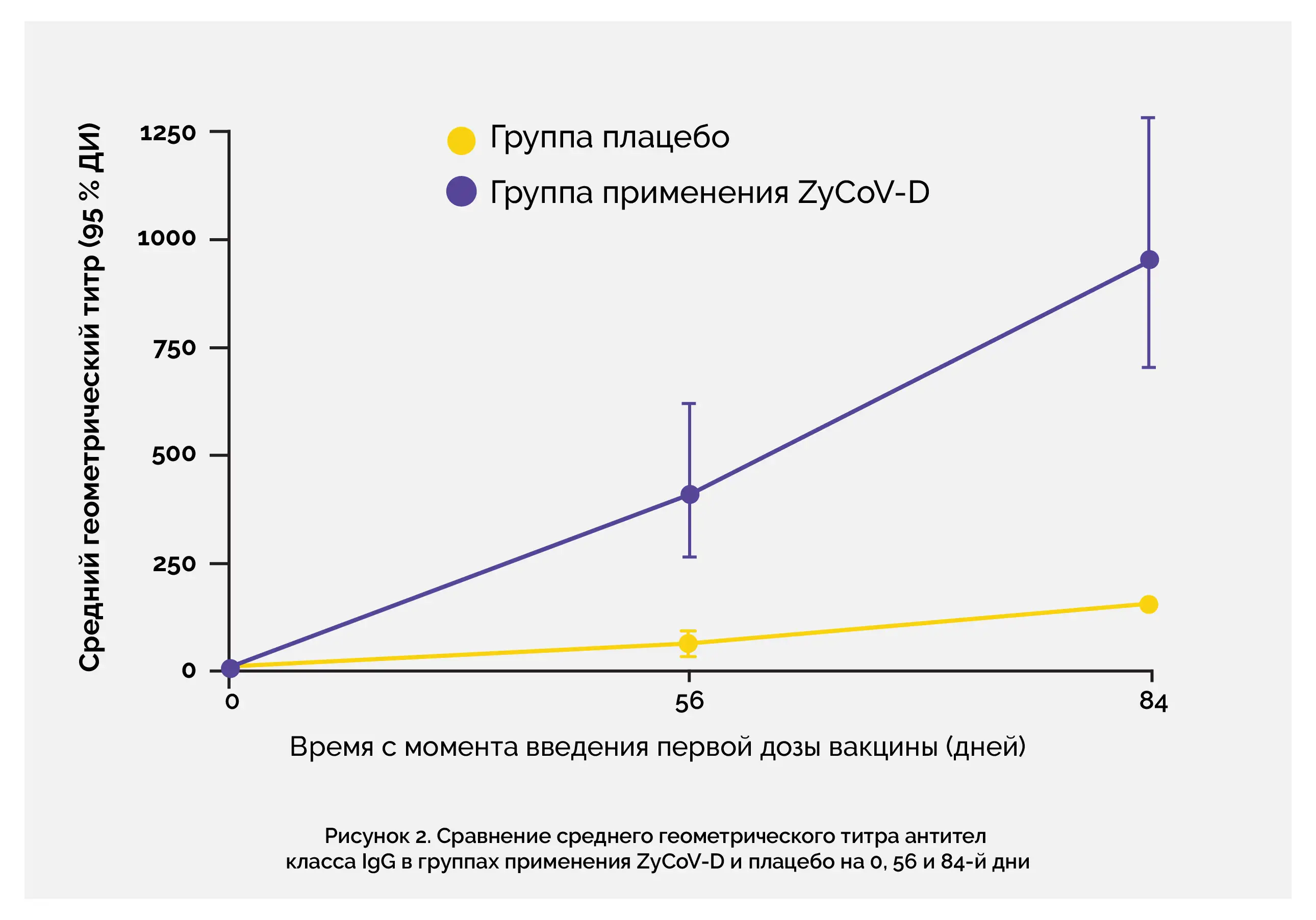
• На 84-й день у групі застосування ZyCoV-D (952,67 ІФА од., 95 % ДІ: 707,94–1282,00) спостерігалася підвищена концентрація антитіл, що визначається за середнім геометричним титром антитіл класу IgG, порівняно з групою плацебо (154,82 ІФА од., 91,25-262,70) (див. рисунок 2)
З урахуванням профілю ефективності та безпеки, отриманого в дослідженні I/II фази, результати клінічного дослідження III фази свідчать про ефективність, безпеку та імуногенність ДНК-вакцини ZyCoV-D для профілактики COVID-19. Ефективність вакцини проти COVID-19 при введенні за трьохдозною схемою внутрішньошкірно за допомогою безголкової системи становила 66,6%. Дослідження проводили під час другої хвилі коронавірусної інфекції, яка була головним чином викликана вірусом штаму B.1.617.2 (дельта).
Наприкінці квітня 2021 р. спостерігалося швидке зростання частки пацієнтів, інфікованих вірусом штаму дельта. Вакцина ZyCoV-D ефективна проти вірусу штаму дельта. У групі застосування ZyCoV-D не зареєстровано жодного випадку коронавірусної інфекції середнього або тяжкого ступеня. Отже, у профілактиці COVID-19 середнього та тяжкого ступеня вакцина була визнана ефективною на 100 %, і на 64,9 % – у профілактиці легкого ступеня захворювання. Таким чином, при повній вакцинації з використанням вакцини ZyCoV-D можна було б значно скоротити кількість випадків COVID-19 середнього та тяжкого ступеня.
У дослідженні III фази імуногенність ZyCoV-D, що спостерігалася у дослідженні I/II фази, зберігалася. Вакцина ZyCoV-D індукувала виражену імунну відповідь на 84-й день, що оцінюється за рівнем сероконверсії (93,33%) на підставі визначення антитіл класу IgG до домену S1 білка (методом ІФА), СГТ (952,67 ІФА од., 95% ДІ 707,94-1282,00), фактору сероконверсії (136,09, 95% ДІ 101,11-183,1), титру нейтралізуючих антитіл (СГТ: 133,39, методом реакції нейтралізації бляшкоутворення (PR50) ДІ: 86,88-204,81; фактор сероконверсії: 26,68, 95% (ДІ: 17,38-40,96). Вакцинація сприяла розвитку вираженої клітинної відповіді, про що свідчив підвищений рівень інтерферону-γ у групі застосування ZyCoV-D у порівнянні з групою плацебо.
Сприятливий профіль безпеки ZyCoV-D був підтверджений під час проміжного аналізу даних дослідження III фази, що узгоджувалося з результатами дослідження I/II фази. Результати свідчать про те, що профіль переносимості ZyCoV-D у пацієнтів із супутніми захворюваннями, пацієнтів віком від 60 років та пацієнтів віком 12–17 років можна порівняти з профілем у загальній популяції дослідження. Випадків розвитку серйозної токсичності не спостерігалося. Основні побічні ефекти були легкого або помірного ступеню тяжкості і минущими. Найбільш частими місцевими побічними ефектами були свербіж, набряк, почервоніння та біль у місці введення. Найчастішими системними побічними ефектами були стомлюваність, біль у м'язах, підвищена температура тіла і головний біль. Ці системні та місцеві побічні ефекти після введення вакцини ZyCoV-D були аналогічні явищам, що спостерігаються у групі плацебо, що вказує на відсутність підвищеного ризику розвитку побічних ефектів при застосуванні вакцини. Ступінь тяжкості і тип побічних ефектів, що спостерігаються, узгоджувалися з такими в дослідженні II фази іншої ДНК-вакцини. Введення вакцини за допомогою безголкової системи має призвести до зменшення частоти розвитку побічних ефектів, пов'язаних із використанням голки, таких як біль у місці введення.
Вакцину слід зберігати при температурі 2-8 °C, але при зберіганні при кімнатній температурі (25 °C) вона зберігає стабільність протягом не менше 3 місяців. Це відповідає критеріям прийнятності, встановленим Управлінням контролю якості харчових продуктів та лікарських засобів США, а також у міжнародних керівництвах. Стабільність вакцини при впливі температур полегшує її зберігання та транспортування та попереджає втрати за рахунок відсутності необхідності дотримання холодового ланцюга.
Платформа плазмідної ДНК забезпечує простоту виробництва за мінімальних вимог до біологічної безпеки. Оскільки ZyCoV-D є вакциною на основі плазмідної ДНК, вона не викликає проблем, пов'язаних з розвитком імунної відповіді, що спостерігаються при використанні векторних вакцин (наприклад, недостатня імунна відповідь на цільові антигени після вакцинації через вже наявні антитіла до векторів в результаті природного інфікування вірусами грипу, кору або аденовірусами).
Інші проблеми, пов'язані із застосуванням векторних вакцин, включають необхідність введення дуже високих доз, що призводять до розвитку численних побічних ефектів, та необхідність збільшення інтервалу між бустерними дозами для зниження впливу вектора на розвиток імунної відповіді. Платформа плазмідної ДНК дозволяє швидко створювати нові структури з урахуванням мутацій вірусу. Трьохдозна схема введення відповідає третій бустерній дозі.
ДНК-вакцина проти COVID-19 для внутрішньошкірного введення (ZyCoV-D) є ефективною, безпечною та імуногенною. Вона придатна для профілактики коронавірусної інфекції у великій популяції, а її виробництво є обґрунтованим та економічно доцільним. Ця вакцина може стати перспективним способом боротьби з пандемією COVID-19.
Lancet
Efficacy, safety, and immunogenicity of the DNA SARS-CoV-2 vaccine (ZyCoV_D): the interim efficacy results of a phase 3, randomised, double-blind, placebo-controlled study in India
Akash Khobragade і співавт.
Коментарі (1)